Igualaciones de ecuaciones por los métodos de ion y oxidación reducción.
El método ión-electrón es útil para balancear ecuaciones correspondientes a reacciones redox (reacciones de óxido-reducción) que ocurren en medio acuoso ácido o alcalino; pero sólo es aplicable a reacciones que ocurren bajo éstas condiciones.
En éste capítulo se van a describir los pasos a seguir para balancear una ecuación química por éste método.
Pasos a seguir:
I) Asignación del número de oxidación a todos los átomos de los compuestos que intervienen en la reacción.II) Ubicar cuáles son los elementos que se oxidan y cuáles son los que se reducen.
III) Disociar todas aquellas especies químicas que son disociables y/o ionizables.
IV) Escribir las hemirreacciones de oxidación y de reducción.
I) Asignación del número de oxidación:
0 +1 –2 +1 +1 –1 +1 +1 –2 +1 -2
Ejemplo:
Se tiene la siguiente ecuación sin balancear:
Cl2 + NaOH Â NaCl + NaClO + H2O
Cl2 + NaOH Â NaCl + NaClO + H2O
Igualaciones por el método de numero de oxidación
Este método balancea la reacción comparando el aumento en el numero de oxidación que sufre este átomo que se oxida con la disminución que experimenta el átomo que reduce.
Este método tiene 2 limitaciones
1.- Sólo se utiliza en reacciones que presentar reducción y oxidación
2.- En muchas ocasiones no resuelve totalmente la ecuación, por lo que se complementa con el método del tanteo
¿Como sabemos cuando una reacción es REDOX?
Se determina el numero de oxidación de los reactantes y de los productos y se observa si los elementos cambiaron o no de numero de oxidación
Es importante saber que:
Oxidación: es cuando un elemento pierde electrones.
Reducción: es cuando un elemento gana electrones.
El método ión-electrón es útil para balancear ecuaciones correspondientes a reacciones redox (reacciones de óxido-reducción) que ocurren en medio acuoso ácido o alcalino; pero sólo es aplicable a reacciones que ocurren bajo éstas condiciones.
En éste capítulo se van a describir los pasos a seguir para balancear una ecuación química por éste método.
Pasos a seguir:
I) Asignación del número de oxidación a todos los átomos de los compuestos que intervienen en la reacción.
II) Ubicar cuáles son los elementos que se oxidan y cuáles son los que se reducen.
III) Disociar todas aquellas especies químicas que son disociables y/o ioniza bles.
IV) Escribir las insurrecciones de oxidación y de reducción.
I) Asignación del número de oxidación a todos los átomos de los compuestos que intervienen en la reacción.
II) Ubicar cuáles son los elementos que se oxidan y cuáles son los que se reducen.
III) Disociar todas aquellas especies químicas que son disociables y/o ioniza bles.
IV) Escribir las insurrecciones de oxidación y de reducción.
Ejemplo:
Se tiene la siguiente ecuación sin balancear:
Cl2 + NaOH Â NaCl + NaClO + H2O
I) Asignación del número de oxidación:
0 +1 –2 +1 +1 –1 +1 +1 –2 +1 -2
Cl2 + NaOH Â NaCl + NaClO + H2O
0 +1 –2 +1 +1 –1 +1 +1 –2 +1 -2
Cl2 + NaOH Â NaCl + NaClO + H2O
II) Ubicar cuáles son los elementos que se oxidan y cuáles son los que se reducen:
Hay que tener en cuenta que se define como oxidación la pérdida de electrones y por lo tanto aumento del número de oxidación; y que se define como reducción la ganancia de electrones o disminución del número de oxidación. Cuando se habla de aumento del número de oxidación se quiere dar a entender que éste se hace más positivo, y cuando se habla de disminución del número de oxidación se quiere dar a entender que éste se hace más negativo.
Hay que tener en cuenta que se define como oxidación la pérdida de electrones y por lo tanto aumento del número de oxidación; y que se define como reducción la ganancia de electrones o disminución del número de oxidación. Cuando se habla de aumento del número de oxidación se quiere dar a entender que éste se hace más positivo, y cuando se habla de disminución del número de oxidación se quiere dar a entender que éste se hace más negativo.
En nuestro ejemplo vemos que el cloro ( Cl2 ) cambia su número de oxidación de 0 a –1 cuando forma parte del NaCl, su número de oxidación disminuye, por lo tanto se reduce.
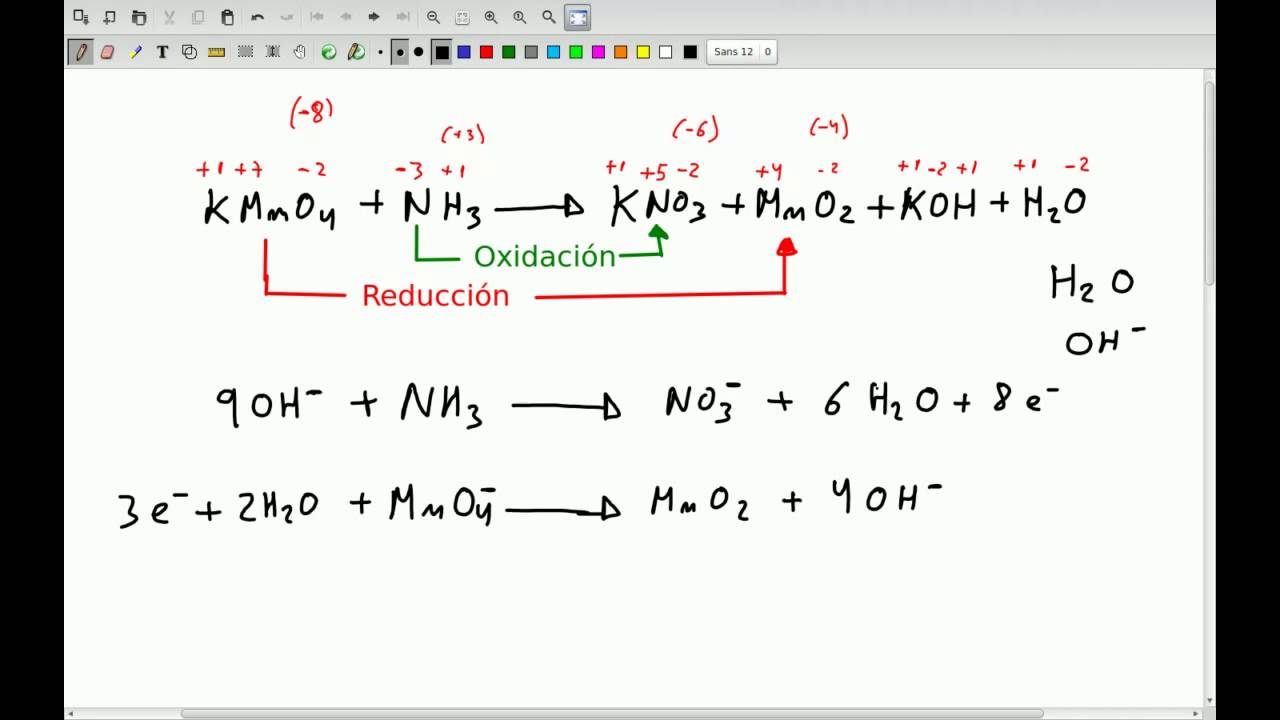
Igualación de reacciones que transcurren en el medio básico
En medio básico se agregan iones hidróxilo (aniones) (OH−) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
Ecuación sin balancear:
Separamos las semirreacciones en
- Oxidación:
- Reducción:
Agregamos la cantidad adecuada de Hidróxidos y Agua (las moléculas de agua se sitúan en donde hay mayor cantidad de oxígenos).
- Oxidación:
- Reducción:
Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.
- Oxidación:
- Reducción:
Obtenemos:
- Oxidación:
- Reducción:
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
.